Fake News
Obalamy fałszywe informacje pojawiające się w mediach społecznościowych oraz na portalach internetowych. Odwołując się do wiarygodnych źródeł, weryfikujemy najbardziej szkodliwe przykłady dezinformacji.
Nie, szczepionka na SARS-CoV-2 nie jest ukrywana od marca
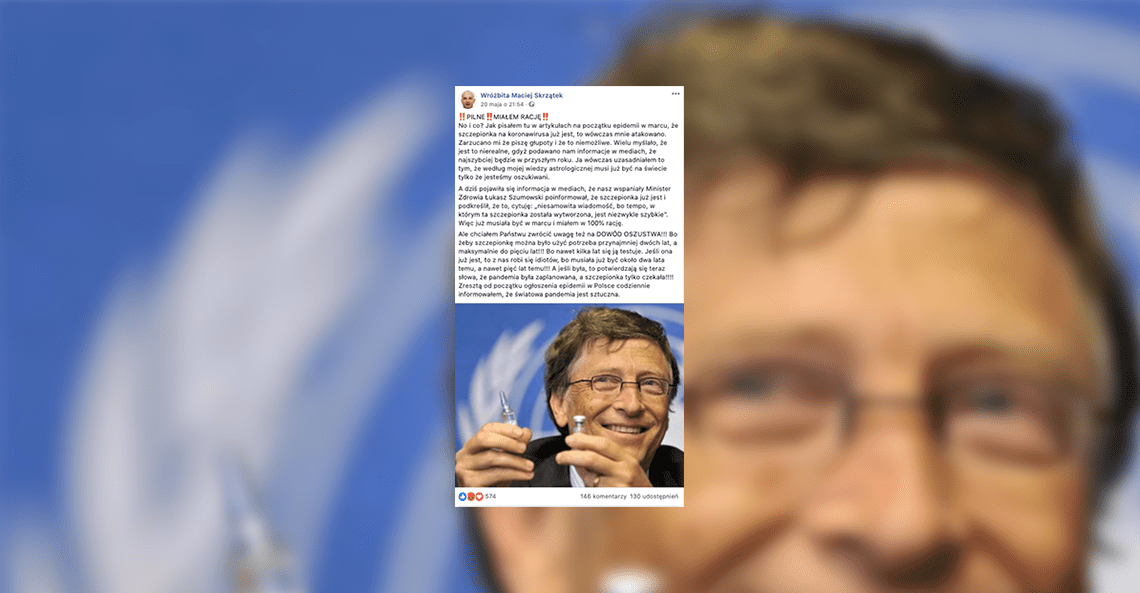
Wróżbita Maciej Skrzątek twierdzi, że szczepionka na koronawirusa istnieje już mniej więcej od 22 marca, jednak jest ukrywana. Nie ma to jednak potwierdzenia w faktach.
Nie, szczepionka na SARS-CoV-2 nie jest ukrywana od marca
Wróżbita Maciej Skrzątek twierdzi, że szczepionka na koronawirusa istnieje już mniej więcej od 22 marca, jednak jest ukrywana. Nie ma to jednak potwierdzenia w faktach.
20 maja wróżbita Maciej Skrzątek opublikował na swoim profilu na Facebooku post, w którym stwierdził, że „według jego wiedzy astrologicznej” szczepionka na koronawirusa została opracowana już w marcu.
Słowa wróżbity ma potwierdzać informacja podana przez ministra zdrowia Łukasza Szumowskiego na konferencji prasowej 19 maja, że szczepionka już jest i że tempo jej wytworzenia jest bardzo szybkie. Dodatkowym argumentem ma być to, że według Skrzątka prace nad taką szczepionką trwają od 2 do 5 lat. Istnienie szczepionki na COVID-19 dodatkowo utwierdziło go w przekonaniu, że pandemia została sztucznie wykreowana.
Opublikowany 20 maja post został skomentowany niemal 150 razy, 574 użytkowników zostawiło pod nim reakcję, uzyskał też 130 udostępnień. Większość opinii wyraża poparcie dla Wróżbity Macieja, wiele osób zgadza się z tym, że szczepionka istnieje od dłuższego czasu, a wręcz że została tworzona razem z wirusem.
Publikacja stanowi odwołanie do wcześniejszego posta Skrzątka, który został już przez niego usunięty. 18 kwietnia wyjaśnił on powody swojej decyzji oraz przypomniał, czego dotyczyła usunięta treść. Jak czytamy:
Napisałem w nim, że według astrologii szczepionka na świecie już jest od 22 marca 2020. Uzasadniłem to tym, że od tej daty planeta Saturn znajduje się w znaku Wodnika. A oznacza to wynalazki i odkrywanie. Napisałem też, że według astrologii trzymana jest w tajemnicy, gdyż planeta Neptun przebywa w znaku Ryb i to symbolizuje sekrety oraz wszystko co jest ukryte. Poinformowałem również, że obecny układ planety Neptun w znaku Ryb określa obłęd, manipulacje i przekłamania.
(…)
Post usunąłem. Dlaczego? Bo jestem osobą, która do życia podchodzi z rozsądkiem. Podejrzewam, że na jakiejś wewnętrznej grupie został zamieszczony link do tego posta z informacją, by mnie uciszyć.
Wróżbita Maciej wyjaśnia, że informacja o istnieniu szczepionki zostanie ujawniona, dopiero gdy ze strachu będziemy wstanie zapłacić za nią każdą cenę. Słowa te wywołały falę nieprzychylnych komentarzy i hejtu. Było to dla niego na tyle uciążliwe, że wróżbita usunął publikację. Twierdzi on również, że szczepionka będzie warunkiem zdjęcia maseczek, zastanawiając się jednocześnie, czy przełoży się to na obowiązek przyjęcia samej szczepionki. Na końcu autor przypomina swoją główną tezę: szczepionka już istnieje, a jeśli zostanie podana społeczeństwu w tym lub przyszłym roku, będzie to tylko potwierdzenie, że istniała wcześniej, a pandemia była zaplanowana, ponieważ szczepionki testuje się od roku do kilku lat – jak twierdzi wróżbita.
Czy to prawda, że szczepionka na SARS-CoV-2 już istnieje?
Wypowiedź ministra zdrowia, do której odwołuje się Wróżbita Maciej, pochodzi z konferencji prasowej 19 maja. To podczas niej Łukasz Szumowski, odpowiadając na pytanie dziennikarki o ozdrowieńców, podzielił się „fantastycznymi wiadomościami” o dopuszczeniu do podawania chorym leku, który był badany w Polsce i w Stanach Zjednoczonych, oraz poddaniu testom pierwszej szczepionki wytwarzającej przeciwciała w organizmie. Minister docenił tempo, w którym została ona wynaleziona. Podkreślił jednak, że teraz istotne będą wyniki testów bezpieczeństwa. Szumowski wyraził nadzieję, że dzięki lekowi i szczepionce za jakiś czas COVID-19 będzie zaliczony do chorób możliwych do opanowania. Dokładny fragment rozmowy (od 15. minuty 55. sekundy):
Najbardziej fantastyczna wiadomość, a właściwie dwie, ostatnich dni, to jest to, że został dopuszczony lek na koronawirusa, który był badany również zresztą w Polsce, a po drugie właśnie usłyszeliśmy, że pierwsza szczepionka, pierwsza grupa badawcza w Stanach Zjednoczonych testy przeprowadziła ze swoją szczepionką i okazuje się, że ta szczepionka daje efekty, to znaczy wytwarza przeciwciała w organizmach. To jest niesamowita wiadomość, bo tempo, w którym ta szczepionka została wytworzona, wynaleziona, jest niezwykle szybkie, no jeszcze czekamy oczywiście tutaj na wyniki bezpieczeństwa, bo to jest chyba jeszcze ważniejsze, niż skuteczność.
Remdevisir
Lek, o którym wspomina minister Szumowski, to remdesivir, produkt opracowany przez firmę Gilead Sciences z USA. 1 maja Amerykańska Agencja ds. Żywności i Leków (FDA) wydała zgodę na awaryjne stosowanie remdesiviru w leczeniu pacjentów z ciężkimi przypadkami COVID-19.
18 maja Szef Europejskiej Agencji Leków (EMA) Guido Rasi podczas wysłuchania w Parlamencie Europejskim zapowiedział, że remdevisir może uzyskać warunkową autoryzację rynkową. Obecnie EMA dopuszcza stosowanie remdevisiru w ramach procedury humanitarnego użycia, compassionate use. Jest to sytuacja analogiczna do wspomnianej wyżej amerykańskiej autoryzacji awaryjnego użycia (Emergency Use Authorization, EUA).
Obie procedury przewidują wykorzystanie leków o niepotwierdzonym działaniu lub skutkach ubocznych w leczeniu poważnych lub zagrażających życiu chorób, na które nie ma jeszcze zatwierdzonych i dostępnych alternatywnych form leczenia. Kuracja takimi lekami odbywa się pod ścisłym nadzorem ze strony lekarzy.
Z kolei rozważana przez EMA warunkowa autoryzacja rynkowa (Conditional Marketing Authorisation) remdevisiru stanowiłaby kolejny etap w dopuszczeniu do powszechnego stosowania tego leku w leczeniu COVID-19. Procedura ta może zostać wdrożona tylko, jeśli zostaną spełnione wszystkie poniższe kryteria:
- korzyści ze stosowania produktu przewyższą ryzyka,
- będzie prawdopodobne, że wnioskodawca przedstawi szczegółowe dane dotyczące produktu,
- stosowanie produktu wypełni dotychczas niespełnione potrzeby medyczne,
- korzyści dla zdrowia publicznego płynące z powszechnej dostępności danego produktu na rynku przewyższą ryzyka związane z koniecznością uzyskania bardziej szczegółowych informacji na temat tego leku.
Według wstępnych wyników badań remdevisir może być pomocny w leczeniu ciężkich przypadków COVID-19. Nie został on jednak do tej pory zatwierdzony oficjalnie jako lek na COVID-19 ani przez Światową Organizację Zdrowia, ani przez Europejską Agencję Leków, ani też przez Amerykańską Agencję ds. Żywności i Leków.
Szczepionka
Z kolei szczepionka, o której wspominał w swojej wypowiedzi Łukasz Szumowski, to szczepionka mRNA-1273 opracowywana przez amerykańską firmę Moderna. 18 maja Moderna poinformowała o pozytywnych wynikach pierwszej fazy testów klinicznych szczepionki prowadzonych przez amerykański Narodowy Instytut Alergii i Chorób Zakaźnych.
Podano ją grupie zdrowych ochotników w wieku 18-55 lat w trzech różnych dawkach: 25, 100 lub 250 mikrogramów. Organizm każdego z uczestników badania w ciągu 15 dni od pierwszej dawki szczepionki zaczął wytwarzać przeciwciała. Pomyślny przebieg pierwszej fazy testów nie oznacza jednak, że szczepionka jest już teraz gotowa do użytku, ani tym bardziej, że była opracowana już w marcu lub wcześniej, jak sugeruje wróżbita Maciej.
Kalendarium prac nad szczepionką Moderny przedstawia się następująco:
- 10 stycznia 2020 roku – Chiny publikują pierwszy zsekwencjonowany genom wirusa SARS-CoV-2,
- 23 stycznia – Moderna informuje o pozyskaniu dofinansowania z CEPI (Coalition for Epidemic Preparedness Innovations) na rzecz przyspieszenia prac nad szczepionką na SARS-CoV-2,
- 7 lutego – wyprodukowana zostaje pierwsza porcja szczepionki,
- 24 lutego – pierwsza porcja szczepionki zostaje przekazana do NIH celem rozpoczęcia pierwszej fazy testów klinicznych,
- 4 marca – FDA zatwierdza złożoną przez NIH aplikację i umożliwia rozpoczęcie pierwszej fazy testów klinicznych mRNA-1273,
- 16 marca – pierwszy uczestnik pierwszej fazy testów klinicznych otrzymuje dawkę mRNA-1273,
- 20 marca – Stephane Bancel, CEO Moderny, w wywiadzie wyraża opinię, że o ile szczepionka mRNA-1273 będzie dostępna na rynku co najmniej za 12-18 miesięcy, możliwe jest awaryjne wykorzystanie jej w ograniczonych przypadkach już jesienią 2020 roku,
- 27 marca – NIH ogłosiła nabór ochotników do pierwszej fazy testów klinicznych mRNA-1273,
- 16 kwietnia – Moderna otrzymuje 483 mln dolarów od BARDA (amerykańska agencja rządowa zajmująca się badaniami biomedycznymi i rozwojem szczepionek) na przyspieszenie prac nad szczepionką mRNA-1273. Środki mają być przeznaczone na rozwój możliwości produkcyjnych firmy,
- 27 kwietnia – Moderna składa wniosek o rozpoczęcie drugiej fazy testów klinicznych. Ma ona objąć 600 uczestników w razie pozytywnych wyników pierwszej fazy testów. Moderna przewiduje także, że trzecia faza testów klinicznych mogłaby rozpocząć się jesienią 2020 roku,
- 6 maja – FDA zezwala Modernie na przejście do drugiej fazy testów klinicznych. Na 600 uczestników drugiej fazy testów mają złożyć się dwie grupy uczestników liczące po 300 osób – jedna grupa składająca się z osób w wieku 18-55 lat, druga grupa – osób powyżej 55 roku życia,
- 12 maja – FDA przyznaje Modernie szybką ścieżkę w zakresie szczepionki mRNA-1273,
- 18 maja – Moderna ogłasza wyniki pierwszej fazy testów,
- 29 maja – pierwszy uczestnik drugiej fazy testów otrzymuje szczepionkę. Badania drugiej fazy mają potrwać łącznie 12 miesięcy i sprawdzić bezpieczeństwo, reaktogeniczność i immunogeniczność dwóch dawek szczepionki podanych w odstępie 28 dni.
Szybkie tempo prac nad szczepionką na SARS-CoV-2 było możliwe z kilku powodów. Po pierwsze, Moderna we współpracy z NIAID pracowała już wcześniej nad szczepionkami na inne koronawirusy, SARS-CoV oraz MERS-CoV. Koronawirusy te mają zbliżoną budowę do SARS-CoV-2, każdy z nich zawiera bowiem białko strukturalne S („kolec” koronawirusa), które odpowiada za przenikanie wirusa do komórki docelowej. To właśnie na tym białku koncentrowały się prace naukowców nad szczepionką na poprzednie koronawirusy, dlatego też w momencie zsekwencjonowania genomu nowego koronawirusa SARS-CoV-2 możliwe było natychmiastowe przystąpienie do prac nad szczepionką na niego, bazując na istniejącej już platformie mRNA.
https://www.youtube.com/watch?v=qJlP91xjvsQ
Po drugie, Moderna pozyskuje dodatkowe fundusze na rzecz przyspieszenia tempa prac nad szczepionką. Po trzecie, korzysta z przyśpieszonych procedur administracyjnych przyznawanych przez FDA.
Jak wyglądają testy szczepionek?
Zanim nowa szczepionka zostanie dopuszczona do użytku, musi zostać zbadana w celu ustalenia, czy jest bezpieczna i skuteczna. Proces ten rozpoczyna się od testów w badaniach laboratoryjnych oraz na zwierzętach, aby wstępnie ocenić bezpieczeństwo i immunogenność. Jeżeli wyniki przeprowadzonych badań są korzystne, przechodzi się do kilku etapów badań klinicznych na ludziach. Pozytywne przejście wszystkich badań jest wymagane, aby uzyskać pozwolenie na dopuszczenie do obrotu, które jest wydawane przez EMA w Unii Europejskiej lub FDA w Stanach Zjednoczonych. Badania kliniczne składają się z trzech faz.
I faza – prowadzona na niewielkiej grupie (zwykle kilkadziesiąt osób) ma za zadanie sprawdzenie, czy szczepionka jest bezpieczna dla ludzi.
II faza – prowadzona jest na większej grupie (zwykle kilkuset osób). Jej celem jest poszukiwanie optymalnej dawki szczepionki i sprawdzenie, czy wywołuje ona pożądane zmiany w układzie odpornościowym człowieka, np. czy wzbudza wytwarzanie przeciwciał.
III faza – obejmuje duże grupy badanych (np. kilka do kilkudziesięciu tysięcy osób). W trakcie badań ocenia się skuteczność szczepionki, sprawdzając, w jakim stopniu zapobiega ona zachorowaniom. Ponadto weryfikuje się, na ile szczepionka jest bezpieczna, a więc czy wywołuje niepożądane odczyny poszczepienne i czy może być podawana z innymi szczepionkami już ujętymi w programach szczepień.
Kiedy zostaje opracowany proces wytwarzania szczepionki, a wyniki kolejnych faz badań klinicznych są zadowalające, producent przedstawia szczegółową dokumentację dotyczącą charakterystyki szczepionki, procesu jej wytwarzania, wyników badań klinicznych dotyczących bezpieczeństwa i skuteczności w stosownej instytucji odpowiedzialnej za rejestrację produktów leczniczych.
Jeżeli szczepionka przeznaczona jest na rynek europejski, producent kieruje się do Europejskiej Agencji Leków (Komitet CHMP), a jeżeli na rynek krajowy – do Urzędu Rejestracji Produktów Leczniczych Wyrobów Medycznych i Produktów Biobójczych. Załączona dokumentacja najpierw jest oceniana pod kątem jakości, bezpieczeństwa i skuteczności przez ekspertów wakcynologów, następnie wydawana jest końcowa decyzja dopuszczenia szczepionki do obrotu. W przypadku szczepionek rejestrowanych w Europejskiej Agencji Leków końcowa decyzja jest wydawana przez Komisję Europejską. Proces oceny szczepionki trwa zwykle od roku do nawet dwóch lat.
Po zarejestrowaniu szczepionki producenci prowadzą badania IV fazy, czyli uzupełniające, w których sprawdzane są inne schematy podawania szczepionki, badane są szczególne grupy osób (przewlekle chorzy, wcześniaki, osoby w wieku podeszłym) oraz kontynuowana jest ocena czasu utrzymywania się odporności.
Zgodnie z informacjami FDA testy kliniczne pierwszej fazy trwają kilka miesięcy. 70 proc. testowanych leków przechodzi z nich do drugiej fazy, trwającej od kilku miesięcy do dwóch lat. Jedynie 33 proc. leków przechodzi do fazy trzeciej, która może trwać od roku do nawet czterech lat. Do czwartej fazy, która ma miejsce już po wypuszczeniu leku na rynek, przechodzi jedynie 25-30 proc. leków.
Tempo prac badawczo-rozwojowych nad szczepionką na SARS-CoV-2 jest więc rzeczywiście bezprecedensowe. Sprzyjają mu takie czynniki, jak dotychczasowy stan wiedzy i stopień zaawansowania prac nad szczepionkami na inne koronawirusy, otwarte dzielenie się wynikami badań nad SARS-CoV-2 i COVID-19, priorytetowy status tej szczepionki dla zdrowia publicznego, skracanie procedur administracyjnych, koordynacja działań ze strony Światowej Organizacji Zdrowia oraz przekazywanie specjalnych funduszy na prace badawczo-rozwojowe.
Nie ma jednak żadnych dowodów potwierdzających tezę o tym, że jakakolwiek szczepionka na SARS-CoV-2 była „gotowa” już w marcu tego roku. Szczepionka opracowywana przez Modernę 18 maja wyszła dopiero z pierwszej, najłatwiejszej i najkrótszej fazy testów klinicznych. Nie jest więc prawdą, że jest już gotowa do użytku.
Bazując na danych FDA, możemy stwierdzić, że na każde 100 badań nad nowymi lekami do fazy drugiej przechodzi aż 70 z nich. Do fazy trzeciej przechodzi już jednak tylko około 23. Do fazy czwartej, a więc do momentu wypuszczenia na rynek, dociera zaledwie 7.
Innymi słowy, jedynie co dziesiąty lek znajdujący się na etapie badań, na którym jest obecnie szczepionka Moderny, trafia ostatecznie na rynek. Jest więc zdecydowanie zbyt wcześnie, by twierdzić, że to właśnie ta konkretna szczepionka skutecznie wyeliminuje zagrożenie związane z COVID-19.
*Jeśli znajdziesz błąd, zaznacz go i wciśnij Ctrl + Enter









