Obalamy fałszywe informacje pojawiające się w mediach społecznościowych oraz na portalach internetowych. Odwołując się do wiarygodnych źródeł, weryfikujemy najbardziej szkodliwe przykłady dezinformacji.
Ten artykuł ma więcej niż 3 lata. Niektóre dane mogą być nieaktualne. Sprawdź, jak zmieniała się metodologia i artykuły w Demagogu.
Testy PCR na koronawirusa mają sens z naukowego punktu widzenia
Artykuł zawiera nieprawdziwe informacje.
Ten artykuł ma więcej niż 3 lata. Niektóre dane mogą być nieaktualne. Sprawdź, jak zmieniała się metodologia i artykuły w Demagogu.

Testy PCR na koronawirusa mają sens z naukowego punktu widzenia
Artykuł zawiera nieprawdziwe informacje.
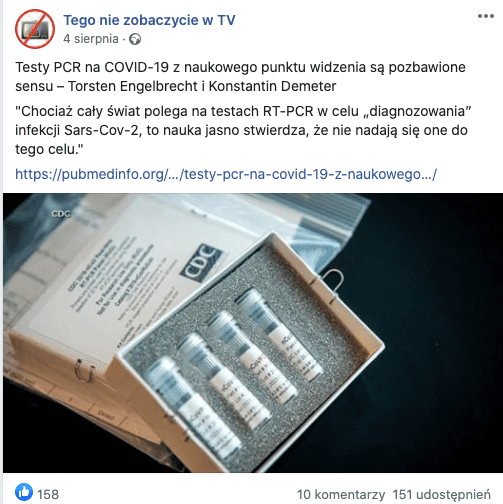
Z początkiem sierpnia w mediach społecznościowych dużą popularność zyskał artykuł kwestionujący sens wykonywania testów PCR w kierunku koronawirusa SARS-CoV-2. Materiał był udostępniany w wielu grupach, które podważają prawdziwość pandemii, jak np. Nie wierzę w Koronawirusa – Grupa wsparcia / NIE JESTEŚ SAM, i na stronach jak Tego nie zobaczycie w TV.
Dla wielu niewierzących w pandemię osób post zawierający takie informacje może być podstawą do dalszego rozprzestrzeniania dezinformacji. Takie podejście może natomiast prowadzić do zmniejszania się świadomości społecznej o skutecznych metodach walki z wirusem, a co za tym idzie – do pogarszania się sytuacji epidemiologicznej w naszym kraju.
O czym jest artykuł?
Materiał zamieszczony został na portalu Pubmedinfo.org, który poprzez zbliżoną nazwę podszywa się pod wiarygodny portal PubMed.gov, na łamach którego publikowane są artykuły naukowe z dziedziny nauk medycznych.
Dominującą tematyką na Pubmedinfo.org są z kolei dezinformujące publikacje o tematyce antyszczepionkowej.
Analizowany artykuł nosi tytuł „Testy PCR na COVID-19 z naukowego punktu widzenia są pozbawione sensu – Torsten Engelbrecht i Konstantin Demeter”. Oryginalny tekst został napisany w języku rosyjskim i zamieszczony na łamach portalu Off Guardian znanego z publikacji teorii spiskowych i rosyjskiej propagandy. Wymienieni w tytule autorzy dowodzą rzekomej nieadekwatności testów PCR do wykrywania koronawirusa SARS-CoV-2. W naszej analizie skupimy się na weryfikacji najważniejszych tez przedstawionych w artykule.
Kary Mullis, wynalazca technologii reakcji łańcuchowej polimerazy (PCR), uznał PCR za niewłaściwy do wykrywania infekcji wirusowej.
Autorzy dla poparcia tej tezy powołują się na inne źródło, czyli artykuł Celii Farber zamieszczony na portalu UncoverDC. Jak przekonuje Farber, Mullis „nie popierałby” wykorzystywania testów PCR do detekcji SARS-CoV-2. Tryb przypuszczający jest tutaj zasadny, gdyż Kary Mullis zmarł przed wybuchem pandemii, w sierpniu 2019 roku. Nie mógł się więc odnieść do kwestii testowania ludzi na obecność SARS-CoV-2.
Farber opiera swoją tezę na rzeczywistym sprzeciwie Mullisa wobec wykorzystywania wynalezionej przez niego technologii PCR (za którą w 1993 roku otrzymał Nagrodę Nobla) do wykrywania wirusa HIV. Kary Mullis zaprzeczał także, że wirus HIV wywołuje AIDS. Obie te tezy (nieadekwatność metody PCR w diagnostyce HIV oraz brak związku HIV-AIDS) nie znajdują jednak potwierdzenia w faktach. Związek pomiędzy HIV a AIDS został udowodniony naukowo, a testy PCR z powodzeniem wykorzystuje się w diagnostyce zakażeń wirusem HIV.
Brak obowiązującego złotego standardu.
Kolejną tezą na nieadekwatność testów PCR ma być fakt, że nie ma złotego standardu, do którego można by przyrównać dokładność samego testu, a COVID-19 nie ma charakterystycznych objawów chorobowych. Jest to fałsz. Jako złoty standard w testowaniu na obecność koronawirusa uznaje się obecnie… właśnie testy PCR. Z kolei wśród objawów charakterystycznych dla COVID-19 Światowa Organizacja Zdrowia wymienia:
jako najczęstsze objawy:
- gorączkę,
- suchy kaszel,
- zmęczenie;
jako mniej częste objawy:
- bóle mięśniowe,
- ból gardła,
- biegunkę,
- zapalenie spojówek,
- ból głowy,
- utratę smaku lub węchu,
- wysypkę skórną lub przebarwienia palców;
jako poważne objawy:
- trudności z oddychaniem lub skrócony oddech,
- ból lub ucisk w klatce piersiowej,
- utratę mowy lub zdolności ruchowych.
Brak dowodu na to, że RNA jest pochodzenia tylko wirusowego
Autorzy twierdzą, że „metoda PCR jest niezwykle czuła, co oznacza, że może wykryć nawet najmniejsze kawałki DNA lub RNA – ale nie może określić, skąd te cząsteczki pochodzą”.
Fałsz.
Najpierw przeanalizujmy, czym jest w ogóle test PCR. Pod skrótem RT-PCR kryje się badanie bazujące na reakcji łańcuchowej polimerazy z odwrotną transkrypcją. W jego trakcie pobiera się wymaz z gardła lub nosogardzieli.
Przebieg testu opisuje oferujący to badanie Szpital Dworska w Krakowie. Po pobraniu próbki materiał trafia do atestowanego laboratorium, a tam zostaje poddany wieloetapowej obróbce. Pierwszym etapem jest wyizolowanie jednoniciowego RNA wirusa z próbki. Na bazie tej matrycy specjalny enzym (odwrotna transkryptaza) przepisuje matrycę na dwuniciowe DNA. Następuje powielenie (amplifikacja) fragmentu DNA. W celu powielenia materiału genetycznego należy znać przynajmniej częściowo sekwencję nukleotydów obu jego końców, dysponować odpowiednim enzymem do reakcji (polimerazą), zestawem odczynników oraz specjalnym urządzeniem – termocyklerem – pozwalającym na cykliczne zmienianie temperatury reakcji.
PCR polega więc na wielokrotnych cyklach podgrzewania i oziębiania próbki. W wysokiej temperaturze (ok. 95°C) następuje proces denaturacji. W niższej temperaturze zawsze określonej dla danej pary starterów na ok. 45-70°C startery przyłączają się do matrycy. Następuje znów podwyższenie temperatury do ok. 72°C i polimeraza DNA syntetyzuje nowy łańcuch z dostępnych substratów mieszaniny reakcyjnej (deoksyrybonukleotydów).
Za pomocą tej techniki można wykryć dowolną sekwencję materiału genetycznego i skutecznie ją powielić. Aktualnie na rynku znajduje się kilka zestawów do testów PCR zawierających specyficzne dla tego wirusa startery, które od razu przyłączają się do wirusowego RNA. Startery te są tak skomponowane, aby były charakterystyczne tylko dla SARS-CoV-2, przez co proces jest znacznie szybszy i dający wiarygodne wyniki. W mieszaninie reakcyjnej znajdują się także specjalne barwniki fluorescencyjne (sondy), które przyłączone do powielanego fragmentu świecą, wzbudzone światłem laserowym. Detekcja świecenia i analiza jego intensywności prowadzi do wnioskowania o ilości powielonego materiału w próbce. Jeśli w badanym materiale nie ma materiału genetycznego wirusa, startery nie przyłączą się do matrycy i nie powielą żadnego odcinka. Jeśli natomiast w próbce znajduje się RNA wirusowe, nawet w śladowej ilości zostanie ono powielone wielokrotnie i wykryte przez urządzenie, a jego ilość określona.
Skąd jednak wiemy, że fragment RNA pochodzi właśnie od koronawirusa SARS-CoV-2? Odpowiedzi udzielił na swoim blogu Virology Down Under australijski mikrobiolog Ian Mackay z Uniwersytetu w Queensland.
Testy typu RT-PCR stosowane do badania wirusa poszukują jedynie niewielkiej części pełnej sekwencji genomu. Ma to sprawić, że testy będą działać tak szybko (godzinę lub mniej) i sprawnie, jak to możliwe.
Metoda PCR “real-time” jest szeroko stosowana od czasu pandemii grypy H1N1 z 2009 roku. Najlepiej sprawdza się ona w przypadku krótszych obszarów docelowych. Metoda RT-PCR w czasie rzeczywistym (RT-rPCR) zawiera produkującą fluorescencyjną sondę DNA. Sonda ta dodaje do testu kolejną warstwę docelowej swoistości. Generuje ona również sygnał, gdy obecne jest wirusowe RNA (gdy go nie ma, nie generuje go). Sonda nie bierze udziału w procesie amplifikacji PCR – po prostu wiąże się z DNA w miarę jego gromadzenia się… w czasie rzeczywistym! Kiedy ilość DNA jest wystarczająca, sonda będzie wytwarzać wykrywalny sygnał fluorescencyjny. Sygnał ten rośnie nieco bardziej w trakcie każdego cyklu, aż do zakończenia PCR.
Ta mała sekwencja zazwyczaj – choć nie zawsze – jest wybierana bezpośrednio pod kątem celu; zarówno startery, jak i sonda wiążą się tylko z zamierzonym celem wirusowym.
PCR czerpie swoją niezwykłą specyficzność ze starterów. Na każdej pozycji nowego startera DNA mamy do wyboru jeden z czterech nukleotydów: dATP, dCTP, dGTP i dTTP. Jeżeli zaprojektowaliśmy specyficzny dla danej sekwencji starter o długości nukleotydów, prawdopodobieństwo, że ta sama dokładna sekwencja wystąpi w sposób losowy, byłoby następujące: (1/4) x (1/4) x (1/4) x (1/4) x (1/4) x (1/4) x (1/4) x (1/4) x (1/4) x (1/4) x (1/4) x (1/4) x (1/4) x (1/4) x (1/4) x (1/4) x (1/4) x (1/4) x (1/4) x (1/4). Oznacza to, że istnieje szansa jak 1 do biliona na w 100 procentach identyczną sekwencję występującą w sposób losowy. Raczej małe szanse. Ten ostatni fragment jest istotny z punktu widzenia tego, jak bardzo specyficzne mogą być testy RT-PCR.
(…)
Stosowane obecnie testy RT-PCR są niezwykle skuteczne przy bardzo czułym i konkretnym wykrywaniu SARS-CoV-2, wirusa powodującego COVID-19. Niektóre działają lepiej od innych, ale wszystkie potrafią bardzo dobrze wykryć SARS-CoV-2. Niektóre wczesne testy RT-rPCR zostały zaprojektowane z myślą o ewentualnej zmianie sekwencji w razie, gdyby wirus ulegał wielu mutacjom (ale tego nie zrobił).
Dodatkowo, testy na SARS-CoV-2 nie wykrywają innych koronawirusów, rinowirusów, adenowirusów, wirusów paragrypowych, wirusów grypy, syncytialnych wirusów oddechowych itd., które można znaleźć w tej samej próbce pacjenta.
Sprawdzamy to również w świecie rzeczywistym. Testujemy inne pokrewne i niepowiązane ze sobą wirusy (jak wymienione wyżej) oraz różne rodzaje próbek ludzkich (smarki, ślina, plwocina, wymazy, płyny itp.) podczas procesu zwanego walidacją. W ten sposób wiemy, co mogą zrobić startery – a tym samym test RT-PCR – a czego nie mogą zrobić. To wszystko jest częścią doświadczenia wypracowanego przez dziesięciolecia stosowania przez nas metod PCR.
Oczywiście źle zaprojektowany test RT-PCR może mieć problemy, podobnie jak wszystko w nauce i życiu. Fałszywe wyniki pozytywne i negatywne mogą się zdarzyć z powodu problemów z projektowaniem testów (nie tylko z powodu problemów z pobieraniem próbek i czasem), ale profesjonalne laboratoria czuwają nad tym, minimalizują ryzyko i mogą je zidentyfikować i skorygować. Spędzają czas na projektowaniu testów, ich optymalizacji i walidacji.
Specjalistycznie zaprojektowane i stosowane testy SARS-CoV-2 zostały dobrze sprawdzone pod kątem wykrywania tego wirusa. Wiodące testy zostały również przetestowane na RNA z SARS-CoV-2 oczyszczonego, wyizolowanego i wyhodowanego w komórkach w laboratorium – wiemy więc, że to właśnie ten wirus wykrywamy. Możemy również zaprojektować i zamówić sekwencje wirusowe w laboratorium i zlecić ich wykonanie komercyjne, zatem znowu wiemy, że testy wykrywają sekwencje wirusowe, których od nich oczekujemy, a nie inne wirusy.
– pisze Mackay.
Kolejną tezą prezentowaną w artykule ma być to, że:
SARS-CoV-2 nie spełnia postulatów Kocha
Fałsz. Czym w ogóle są jednak postulaty Kocha? To sformułowane przez Roberta Kocha cztery twierdzenia dotyczące przyczynowości danej choroby przez określony czynnik zakaźny:
- ten sam organizm musi być obecny w każdym przypadku choroby,
- organizm musi być wyizolowany od chorego gospodarza i wzrastać w czystej hodowli,
- izolat może powodować chorobę po zakażeniu zdrowych, podatnych zwierząt,
- organizm musi być ponownie izolowany od zakażonego zwierzęcia chorego.
Chociaż tezy te są ważne również z punktu widzenia współczesnej epidemiologii, nie znajdują one zastosowania we wszystkich przypadkach. Jak zauważa na swoim blogu profesor Vincent Racaniello, mikrobiolog z Uniwersytetu Columbia, już sam Koch dostrzegał ograniczenia swoich postulatów. Dla przykładu czynnik wywołujący cholerę, a więc bakteria przecinkowca cholery, jest obecny również wśród organizmów zdrowych, co stoi w sprzeczności z postulatem nr 2.
Nie zmienia to jednak faktu, że SARS-CoV-2 spełnia postulaty Kocha. Naukowcy zdołali już wyizolować wirusa od osób zakażonych, rozmnożyli go w warunkach hodowli laboratoryjnej i zainfekowali nim makaki, co wywołało chorobę zbliżoną w swoim przebiegu do COVID-19. Następnie wirus został ponownie wyizolowany od zakażonych już nim zwierząt.
Wysokie wartości Cq sprawiają, że wyniki testu są jeszcze bardziej bezsensowne.
Kolejną tezą prezentowaną w artykule ma by fakt, że „wiele testów PCR ma wartość cykli kwantyfikacji [cykli oznaczania ilościowego]” (cycle quantification – Cq) powyżej 35” (pisownia oryginalna). W rzeczywistości zależy to jednak od jakości przeprowadzanego badania, nie zaś samego testu. Zgodnie z wytycznymi zamieszczonymi w instrukcji Zestawu genesig® real-time PCR do detekcji koronawirusa (COVID-19) firmy Primerdesign przed interpretacją wyników próbek należy zweryfikować prawidłowość przebiegu testu. Jeśli kryteria dotyczące odpowiednich wyników Cq nie są spełnione, należy powtórzyć test (s. 14).
Jak czytamy w rekomendacjach Narodowego Instytutu Zdrowia Publicznego – Państwowego Zakładu Higieny:
Ze względu na wysoką czułość analityczną metody real-time PCR szczególny problem stanowią próbki z wynikiem na granicy czułości analitycznej, tj. gdy powyżej 35 cyklu (CT) uzyskano krzywą sygnału reakcji rtPCR o kształcie „S”. Zgodnie z ogólną zasadą należy wynik badania interpretować zgodnie z zaleceniami producenta zestawu diagnostycznego (dla zestawów ze znakiem IVD). Jednakże w procesie walidacji całego układu diagnostycznego może się okazać, że wskazane przez producenta zestawu kryteria interpretacji wyniku trzeba poddać korekcie w celu uniknięcia wyniku fałszywie dodatniego. Pomocne w tym procesie jest stosowanie kontroli (dodatniej i ujemnej) dostarczonych przez producentów zestawów diagnostycznych i zestawów do izolacji RNA. Zalecany jest także udział w programach zewnętrznej kontroli jakości (EQAs) w przypadku gdy będą dostępne.
Ze względu na różny poziom wiremii (liczba kopii SARS-coV-2 w badanej próbce) w okresie rozwoju zakażenia u różnych osób i w różnym czasie od początku zakażenia, w badaniach laboratoryjnych w kierunku SARS-CoV-2 należy spodziewać się wyników dodatnich na granicy czułości analitycznej. W przypadku, gdy wynik dodatni budzi wątpliwości (wynik słabo dodatni), zgodnie z wytycznymi WHO diagnosta ma prawo wystawić wynik nierozstrzygający i zlecić pobranie do badania kolejnej próbki od pacjenta po 24-48h od momentu pobrania próbki, której wynik dodatni budził wątpliwość. Z reguły po upływie 24-48h poziom wiremii w próbce od pacjenta ulega zmianie – wzrasta lub obniża się tak, iż 2 mieści się w obszarze wyniku pewnego analitycznie tj. pozwala jednoznacznie stwierdzić obecność lub brak obecności materiału genetycznego SARS-CoV-2 w badanej próbce. W przypadku uzyskania wyniku „ujemnego” tj. przy braku wykrycia obecności poszukiwanych markerów genetycznych SARS-CoV-2 należy mieć świadomość, że wynik „ujemny” nie wyklucza zakażenia. Z tego względu, w przypadku gdy pacjent wykazuje objawy typowe dla COVID-19 lub miał udokumentowany bliski kontakt z potwierdzonym przypadkiem COVID-19 wskazane jest wykonanie ponownego badania kolejnej próbki od pacjenta. Alternatywnie można przeprowadzić badanie tej samej próbki innym testem molekularnym jeśli jest dostępny.
Podsumowanie
Analizowany artykuł opublikowany został na portalu, który nie może zostać uznany za wiarygodne źródło informacji. Zawiera on nierzetelne i niezgodne z wiedzą naukową tezy dotyczące testów PCR na obecność koronawirusa SARS-CoV-2.
Technologia ta jest powszechnie wykorzystywana na całym świecie (także w Polsce) do wykrywania koronawirusa, a jej skuteczność została potwierdzona przez Światową Organizację Zdrowia.
Wspieraj niezależność!
Wpłać darowiznę i pomóż nam walczyć z dezinformacją, rosyjską propagandą i fake newsami.

*Jeśli znajdziesz błąd, zaznacz go i wciśnij Ctrl + Enter