Obalamy fałszywe informacje pojawiające się w mediach społecznościowych oraz na portalach internetowych. Odwołując się do wiarygodnych źródeł, weryfikujemy najbardziej szkodliwe przykłady dezinformacji.
Ten artykuł ma więcej niż 3 lata. Niektóre dane mogą być nieaktualne. Sprawdź, jak zmieniała się metodologia i artykuły w Demagogu.
Badania kliniczne na dzieciach nielegalne? Fake news!
Nieprawdziwe informacje na temat testów szczepień przeciw COVID-19.
Ten artykuł ma więcej niż 3 lata. Niektóre dane mogą być nieaktualne. Sprawdź, jak zmieniała się metodologia i artykuły w Demagogu.
Badania kliniczne na dzieciach nielegalne? Fake news!
Nieprawdziwe informacje na temat testów szczepień przeciw COVID-19.
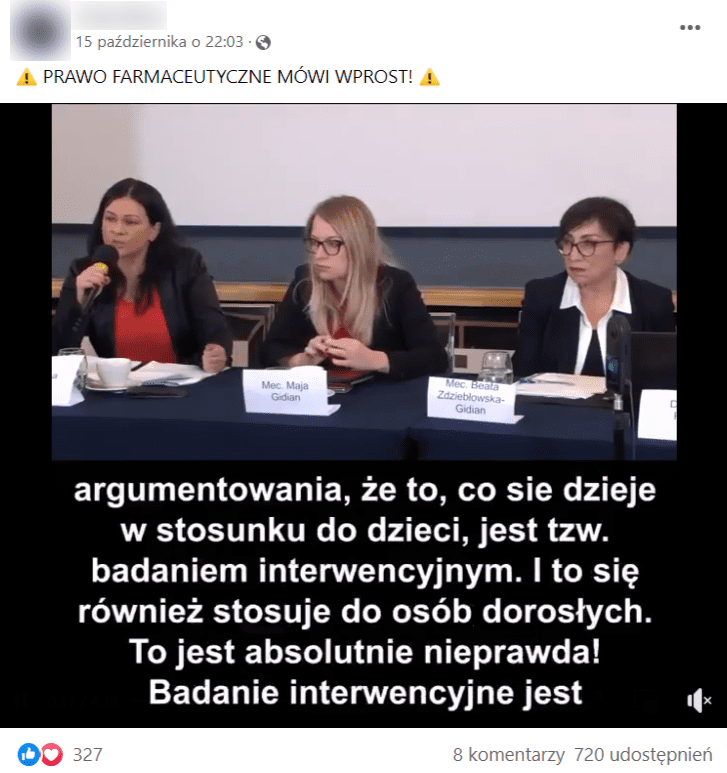
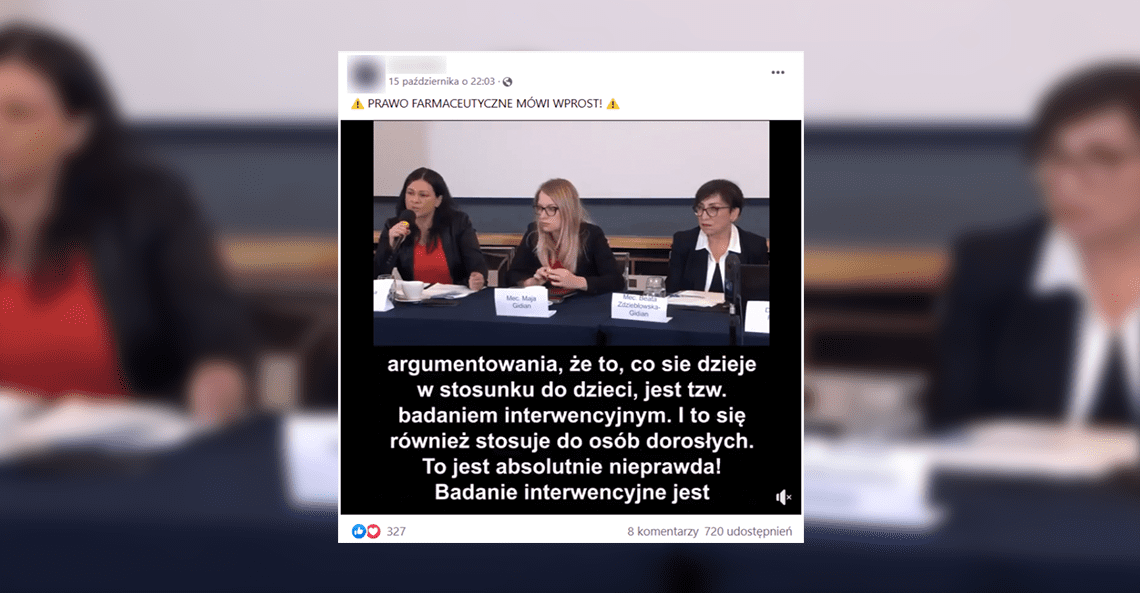
W mediach społecznościowych krąży krótki film z wystąpieniem radczyni prawnej Katarzyny Tarnawy-Gwóźdź na konferencji PSNLiN z 2 października 2021 roku. To prawniczka, która już wcześniej przy okazji innego wystąpienia przekonywała, że szczepienia stanowią eksperyment medyczny. Ta wypowiedź została zweryfikowana przez redakcję Konkret24.
Na nagraniu z października radczyni prawna przekonuje, że szczepionki przeciw COVID-19 stanowią niezgodny z prawem eksperyment medyczny, któremu poddawane są dzieci i dorośli. Film został udostępniony m.in. przez ponad 700 użytkowników Facebooka.
Film zyskał dużą popularność, a internauci, którzy go komentowali, zgadzali się ze zdaniem przedstawionym przez Katarzynę Tarnawę-Gwóźdź. Jak pisali pod postem: „Dziękuję za Państwa wiedzę i walkę o prawdę i nasze prawa”, „Ludzie nie powinni być zmuszani do eksperymentu”.
Czy szczepionki przeciw COVID-19 są eksperymentem medycznym? Nie, ponieważ zostały dopuszczone do etapu szczepień populacyjnych
„Prawo kliniczne mówi wprost – badanie kliniczne jest eksperymentem medycznym. (czas nagrania 00:00) (…) Pojawiają się w mediach głównego nurtu i nie tylko próby argumentowania, że to, co się dzieje w stosunku do dzieci, jest tzw. badaniem interwencyjnym. I to się również stosuje do osób dorosłych (czas nagrania 00:05) (…) Nie mamy do czynienia z badaniem interwencyjnym; mamy do czynienia z ewidentnym badaniem klinicznym, czyli eksperymentem medycznym” (czas nagrania 00:30).
Eksperyment medyczny jest badaniem interwencyjnym. Każde badanie kliniczne to szczególnego rodzaju eksperyment medyczny, o czym możemy przekonać się, zapoznając się z ogólnymi warunkami przeprowadzania badań naukowych i eksperymentów medycznych, przedstawianymi w ramach Kodeksu Etyki Lekarskiej. W przypadku badań nad szczepionkami przeciw COVID-19 mówimy o badaniach klinicznych, ale nie odnosi się to do preparatów, które już zostały wprowadzone na rynek do użytku wśród dzieci i dorosłych.
Szczepionki dopuszczone do obrotu, w tym także dopuszczone warunkowo, nie stanowią eksperymentu medycznego w myśl obowiązujących przepisów, co wyjaśnialiśmy przy okazji analizy opisującej, czym jest eksperyment medyczny. Tylko w przypadku grup młodszych wiekowo (w Polsce: poniżej 12. roku życia), których nie obejmuje ogólnokrajowy program szczepień, można mówić o eksperymencie medycznym w ramach badań klinicznych przeprowadzonych na grupach ochotników. Nie można rozciągać takiej interpretacji na starsze dzieci oraz dorosłych (szczepionki w tym przypadku zostały dopuszczone do masowego użytku), stąd też wypowiedź należy uznać za wprowadzającą w błąd.
Czy na dzieciach nie można prowadzić badań klinicznych? Należy to robić, jeśli w planach jest szczepienie tej grupy wiekowej
Na filmie Katarzyna Tarnawa-Gwóźdź w odniesieniu do badań klinicznych na dzieciach wymienia kilka warunków, które rzekomo zostały złamane w przypadku szczepień przeciw COVID-19. Jak mówiła: „To, co się dzieje jest niedopuszczalne ze względu na treść zarówno prawa międzynarodowego i prawa polskiego. Pierwszą podstawową rzeczą jest dobrowolna i świadoma zgoda na wykonanie tego typu eksperymentu” (czas nagrania 00:41), przekonując dalej, że „Kolejną rzeczą jest to, że żeby w ogóle prowadzić badania medyczne na dzieciach, to muszą być one poprzedzone badaniami na zwierzętach młodocianych” (czas nagrania 01:35). Na końcu podkreśliła, że „Badania kliniczne na dzieciach mogą być prowadzone, jeżeli te dzieci są chore i mają służyć leczeniu bezpośrednio tego dziecka” (czas nagrania 02:00).
Badania kliniczne z udziałem nieletnich są zgodne z prawem międzynarodowym i polskim, a przed ich rozpoczęciem spełnia się szereg norm. W Polsce zgodnie z obowiązującymi przepisami udział osób do 13. roku życia w badaniach klinicznych wymaga zgody przedstawiciela ustawowego, a w przypadku osób powyżej 13. roku życia wymaga się zgody osoby biorącej udział w badaniu oraz przedstawiciela ustawowego (jeżeli między tymi osobami nie ma porozumienia, to sprawę rozstrzyga sąd opiekuńczy).
Bez wcześniejszych badań klinicznych na dzieciach nie można zacząć szczepień w ogólnej populacji pediatrycznej, co wyjaśnia Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych (URPL) w odniesieniu do szczepień przeciw COVID-19.
„Brak produktów leczniczych odpowiednio dostosowanych dla populacji pediatrycznej skutkuje w efekcie niedostępnością odpowiedniej, pod względem postaci i dawki, możliwości leczenia bądź zapobiegania chorobom. Wszelkim obawom przed prowadzeniem badań z udziałem małoletnich należy przeciwstawić obawy etyczne związane z podawaniem małoletnim produktów leczniczych, które na tej populacji nie zostały właściwie przebadane. Temu zagrożeniu zdrowia publicznego można zaradzić w bezpieczny sposób poprzez badania kliniczne z udziałem małoletnich, które są dokładnie kontrolowane, monitorowane oraz zaopiniowane przez komisję etyczną celem zapewnienia ochrony ich uczestników, przede wszystkim zaś dobrowolne„.
Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych (URPL)
Rozporządzenie Ministra Zdrowia z dnia 30 kwietnia 2004 roku w sprawie sposobu prowadzenia badań klinicznych z udziałem małoletnich wskazuje, że przed ich rozpoczęciem „należy uzyskać dane dotyczące toksyczności po wielokrotnym podaniu produktu leczniczego, jego wpływu na rozrodczość i dane dotyczące genotoksyczności uzyskane z badań na młodych zwierzętach laboratoryjnych prowadzonych zgodnie z przepisami dotyczącymi doświadczeń na zwierzętach”.
W celu weryfikacji, z czego może wynikać brak danych dotyczących badań genotoksyczności preparatów szczepionkowych, zwróciliśmy się z zapytaniem do Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych (URPL). W odpowiedzi dowiadujemy się, że:
„Zgodnie z cytowanym rozporządzeniem § 9. (Rozporządzenia Ministra Zdrowia z dnia 30 kwietnia 2004 roku w sprawie sposobu prowadzenia badań klinicznych z udziałem małoletnich – przyp. Demagog). Przed rozpoczęciem badań klinicznych z udziałem małoletnich należy uzyskać dane dotyczące toksyczności po wielokrotnym podaniu produktu leczniczego, jego wpływu na rozrodczość i dane dotyczące genotoksyczności uzyskane z badań na młodych zwierzętach laboratoryjnych prowadzonych zgodnie z przepisami dotyczącymi doświadczeń na zwierzętach. Zakres badań nieklinicznych, w tym badań na zwierzętach jest określony w wytycznych Europejskiej Agencji Leków. Przy ocenie dokumentacji nieklinicznej bierze się pod uwagę m.in. rodzaj badanego produktu i mechanizm jego działania. Dla produktów pochodzenia biotechnologicznego rutynowe badania genotoksyczności nie mają zastosowania. W przypadku omawianej szczepionki, z uwagi na rodzaj produktu i wiedzę na temat mechanizmu działania zakłada się, że nie będzie on oddziaływał bezpośrednio z DNA lub innym materiałem chromosomalnym„.
Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych (URPL)
Odpowiedzi w sprawie udzieliła również Europejska Agencja Leków (EMA). W tym przypadku objaśniono, z czego wynika taka ocena produktów, tj. szczepień przeciw COVID-19:
„Konieczność przeprowadzenia badań rakotwórczości i genotoksyczności szczepionki wynika z rodzaju produktu i jego składu, co wiąże się z wytycznymi wydanymi przez Światową Organizację Zdrowia (https://www.who.int/biologicals/vaccines/nonclinial_evaluation_of_vaccines/en/). Jak widać w niniejszych wytycznych, badania genotoksyczności szczepionek zwykle nie są potrzebne. Mogą być jednak wymagane w przypadku określonych składników szczepionki, takich jak nowe adiuwanty, które zawierają nowe związki chemiczne i nowe dodatki.
Jak widać w informacji o produkcie dla szczepionki Moderna Spikevax (https://www.ema.europa.eu/en/documents/product-information/covid-19-vaccine-moderna-epar-product-information_en.pdf), przeprowadzono badania genotoksyczności in vitro i in vivo nowego lipidowego składnika szczepionki SM-102. Wyniki sugerują, że potencjał genotoksyczności dla ludzi jest bardzo niski. Więcej informacji na temat tych badań można znaleźć w sprawozdaniu: www.ema.europa.eu/en/documents/assessment-report/covid-19-vaccine-moderna-epar-public-assessment-report_en.pdf.
W odniesieniu do Comirnaty, jak wyjaśniono w raporcie (dostępnym tutaj: https://www.ema.europa.eu/en/documents/assessment-report/comirnaty-epar-public-assessment-report_en.pdf), nie przeprowadzono badań genotoksyczności, co uznano za dopuszczalne, ponieważ składniki szczepionki nie powinny mieć potencjału genotoksycznego. Nowa substancja ALC-0159 zawiera potencjalne grupy acetamidowe. Ocena ryzyka przeprowadzona przez wnioskodawcę wskazuje, że ryzyko genotoksyczności związanej z tą substancją pomocniczą jest bardzo niskie, co oceniono na podstawie danych z dostępnej literatury, w której genotoksyczność acetamidu opisuje się jako związaną z dużymi dawkami i długotrwałym podawaniem (≥1000 mg/kg/dobę). Ponieważ ilość substancji pomocniczej ALC-0159 w gotowym produkcie jest niewielka (50 µg/dawkę), a jej oczyszczanie u ludzi jest wysokie, a przy tym zaleca się dwie dawki produktu, ocenia się, że ryzyko genotoksyczności jest bardzo niskie.
Jeśli chodzi o szczepionki Vaxzevria i COVID-19 Vaccine Janssen, to w tych produktach nie stosuje się adiuwantów ani nowych substancji pomocniczych. Z tego względu uznano, że brak badań genotoksyczności jest akceptowalny i zgodny z aktualnymi wytycznymi”.
Katarzyna Tarnawa-Gwóźdź mówi również, że dzieci muszą „być chore” (czas nagrania 01:56), by móc przeprowadzać badania kliniczne z ich udziałem, co nie jest zgodne z prawdą. Dlaczego badań klinicznych nad szczepieniami nie przeprowadza się na chorych dzieciach? Wątpliwości w tej sprawie ponownie rozwiewa Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych (URPL).
„(…) większość toczących się badań klinicznych dotyczy pacjentów z określoną chorobą. W przypadku szczepionek badania są prowadzone na populacjach osób zdrowych, gdyż co do zasady szczepionki są przeznaczone dla zdrowych osób jako środek służący zapobieganiu rozwojowi choroby. Warunkiem dopuszczenia do obrotu wszystkich stosowanych obecnie szczepionek były badania kliniczne prowadzone z udziałem populacji, do której szczepionka została skierowana”.
Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych (URPL)
Czy szczepionki są reklamowane wśród nieletnich (co narusza obowiązujące prawo)? Nie, to stwierdzenie, które dementowaliśmy w innej analizie
Na nagraniu Katarzyna Tarnawa-Gwóźdź mówi również o reklamowaniu szczepień wśród nieletnich: „Jeżeli chodzi o kwestię reklamowania szczepień w stosunku do dzieci, czyli zachęcania do szczepień. Tutaj mamy kolejne bardzo wyraźnie wskazane zakazy tego typu działań (…). Prawo farmaceutyczne mówi wprost, iż zakazana jest reklama produktów leczniczych kierowanych do dzieci” (czas nagrania 02:44). Na tej podstawie radczyni prawna zakłada, że propagowanie szczepień wśród młodzieży jest nielegalne, ale nie odpowiada to prawdzie.
Kampania informacyjna poświęcona szczepieniom przeciw COVID-19 kierowana do nieletnich nie stanowi reklamy, o czym przeczytasz w analizie pt. „Kampania informacyjna o szczepieniach nielegalna? Fake news!”. Inicjatywa ta prowadzona w ramach „Narodowego Programu Szczepień przeciw COVID-19” nie spełnia kryteriów, by można było ją uznać za reklamę produktu leczniczego. Nie promuje żadnego konkretnego preparatu, a ma jedynie uświadamiać o wadze szczepień populacyjnych.
Podsumowanie
Testy kliniczne szczepień przeciw COVID-19 na nieletnich są zgodne z polskim i międzynarodowym prawem. Na podstawie takich badań można sprawdzić bezpieczeństwo i skuteczność szczepień na grupie młodszej wiekowo, zanim preparaty zostaną dopuszczone do użytku. Z wiarygodnymi informacjami na temat szczepionek przeciw COVID-19 można zapoznać się na stronach Światowej Organizacji Zdrowia, Amerykańskiego Centrum ds. Zapobiegania i Kontroli Chorób, Europejskiej Agencji Leków, a także w białej księdze pt. „Szczepienia przeciw COVID-19. Innowacyjne technologie i efektywność”, opracowanej przez inicjatywę Nauka przeciw pandemii.
Nie musisz działać jak automat i udostępniać informacji bez sprawdzenia. Najwyższy czas wyłączyć automatyczny tryb i przełączyć się na myślenie.
Zobacz, co przygotowali dla Ciebie nasi ambasadorzy: Kasia Gandor, Martin Stankiewicz, Ola i Piotr Stanisławscy (Crazy Nauka), Marcin Napiórkowski oraz Joanna Gutral.
Wspieraj niezależność!
Wpłać darowiznę i pomóż nam walczyć z dezinformacją, rosyjską propagandą i fake newsami.

*Jeśli znajdziesz błąd, zaznacz go i wciśnij Ctrl + Enter